La creación en el corto plazo en la AEMPS de la “Oficina de Evaluación de la Eficiencia de los Medicamentos (OEEM)”, y en el largo plazo de una “Comisión Nacional de Evaluación en el Ámbito de la Salud (CNEAS)”, una agencia evaluadora potente, configurada como autoridad administrativa independiente, es la principal propuesta de la tercera nota técnica sobre evaluación de tecnologías sanitarias en España, de una serie recientemente publicada por Funcas, cuyos autores somos Juan Oliva, José Vida y el firmante de este artículo. Como antecedentes, la primera nota analiza la evolución de la regulación y la práctica de la EETS en España y la segunda la deficiente organización administrativa a su servicio. En este blog ya las hemos resumido explicando en qué consiste la EETS, las barreras que se le oponen, su insuficiente regulación, su desarrollo en la práctica y las últimas tendencias y la confusa organización administrativa encargada de ella.
Para fundamentar nuestras propuestas hemos revisado cómo se organiza la EETS en países avanzados. También hemos examinado los modelos previstos en el marco legal español: órgano especializado, organismo autónomo, agencia estatal, autoridad administrativa independiente y fundación del sector público. La elección es importante pues la organización condiciona el desarrollo de las funciones y el éxito de las políticas públicas. Igualmente tenemos en cuenta el diseño de otras organizaciones españolas relevantes, sanitarias (AESAN, AEMPS, o la proyectada AESAP) y no sanitarias (AIReF, Tribunales Especiales de Contratación, OIReScon, CNMC, la frustrada AEVAL).
Proponemos dos escenarios sucesivos, de corto y medio plazo. El primero, posibilista, fácilmente encajable en la estructura actual, es la creación de la “Oficina de Evaluación de la Eficiencia de los Medicamentos (OEEM)”, como órgano adscrito a la AEMPS, funcionalmente independiente y circunscrito al objetivo de la evaluación de la eficiencia y al ámbito del medicamento. Podría crearse por un Real Decreto que modificara el Estatuto de la AEMPS.
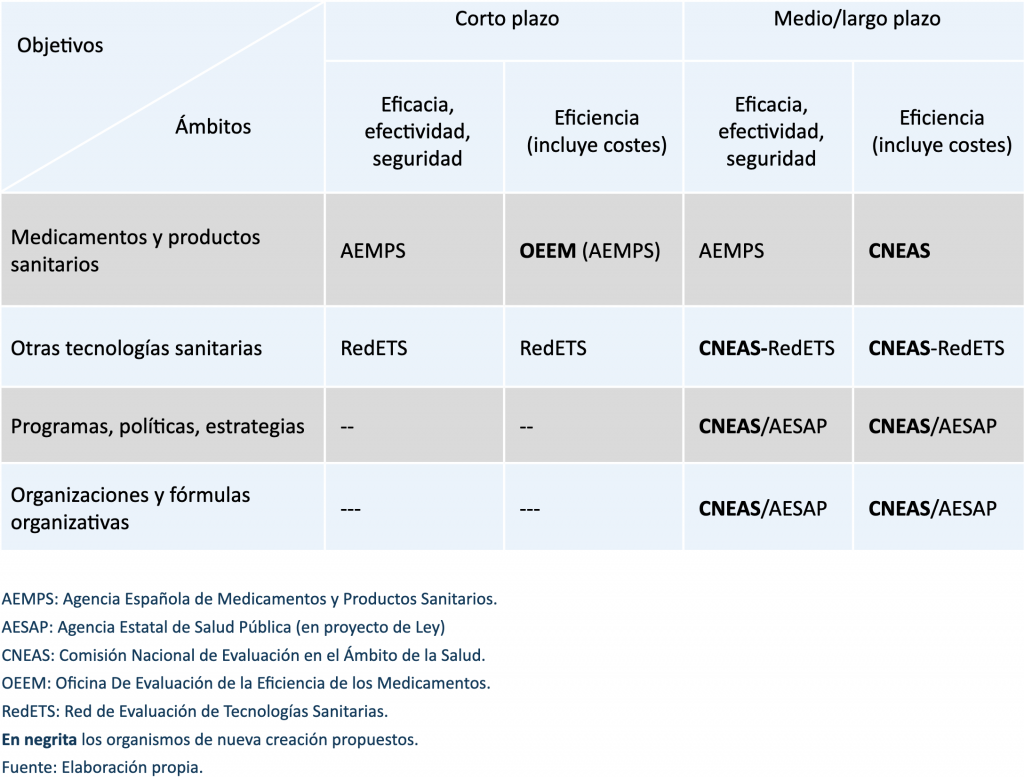
En el medio plazo, recomendamos crear una “Comisión Nacional de Evaluación en el Ámbito de la Salud (CNEAS)”, una agencia evaluadora potente, configurada como autoridad administrativa independiente de la Ley de Régimen Jurídico del Sector Público, a establecer por ley. Como se ve en la figura, una primera opción sería que la CNEAS se ocupara de los dos posibles objetivos (eficacia y seguridad y además eficiencia) y cubriera los ámbitos de (i) los medicamentos y los productos sanitarios; (ii) otras tecnologías sanitarias; (iii) programas, políticas y estrategias; (y iv) organizaciones y fórmulas organizativas. La AEMPS, dada su fortaleza, seguiría haciendo la evaluación clínica de eficacia, efectividad y seguridad de medicamentos y productos sanitarios. La actual RedETS seguiría funcionando, pero la nueva CNEAS, con medios sustancialmente reforzados, absorbería al actual órgano estatal (AETS del ISCIII) y desempeñaría la función de coordinación. Se mantendría la actual pirámide decisoria para la incorporación de tecnologías al SNS: RedETS, CISNS, con su Comisión de Prestaciones, y Ministerio de Sanidad. Se potenciaría así la Red y se simplificaría la estructura. Además, habría que delimitar las funciones con otros organismos. Así, la evaluación de programas y políticas de salud pública podría ser protagonizada por la proyectada AESAP.
Una segunda opción sería restringir el ámbito de la CNEAS a medicamentos, productos sanitarios y otras tecnologías sanitarias y su objetivo a la eficiencia, manteniendo a la AEMPS y a la RedETS con sus cometidos actuales en relación con la eficacia y seguridad. El coste de esta segunda opción es renunciar a las sinergias que surgirían de la unificación. El Ministerio de Sanidad garantizaría siempre la coherencia y la coordinación.
Elementos clave de la propuesta de OEEM y CNEAS son: mandato claro, independencia, observancia del Buen Gobierno, exigencia metodológica, operatividad, y suficiencia de medios. La misión de la OEEM y la CNEAS sería generar información de calidad científico-técnica útil para la toma de decisiones, con independencia funcional, lo que implica separar los procesos de evaluación y decisión. Esta autonomía tendría que combinarse con una estricta coordinación con la AEMPS y la RedETS y otras Administraciones Públicas. Sus análisis de evaluación se seleccionarían con arreglo a prioridades claras (relevancia para la salud, impacto presupuestario). Los estudios iniciales se aportarían por las empresas interesadas y el evaluador los informaría, analizando su fiabilidad y solidez científica y, en su caso, exigiendo o encargando estudios alternativos o mejoras. Serían informes preceptivos no vinculantes, pero el decisor podría incorporar otros criterios en la decisión final.
En cuanto a su estructura, la OEEM sería un sencillo órgano administrativo inserto en la AEMPS, mientras que la CNEAS como autoridad administrativa independiente, contaría con personalidad jurídica, patrimonio, ingresos y tesorería propios y una cierta complejidad organizativa. Ambas serían entidades colegiadas y se apoyarían en una red de expertos externos. Son clave el estatuto del personal directivo y técnico y la congruencia de los medios materiales con la misión, objetivos y volumen de actividad, con garantías de dotación presupuestaria suficiente, incluida la vinculación de las tasas a percibir.
La observancia de los principios de Buen Gobierno es decisiva para que la entidad evaluadora tenga credibilidad y sus recomendaciones sean aceptadas por los decisores, las empresas, los profesionales sanitarios y la ciudadanía. Dichos principios incluyen planificación, transparencia, participación de los agentes sociales interesados y rendición de cuentas.
Para finalizar, hay que recordar que la EETS es estratégica, por su contribución a la salud, por los recursos que movilizan, sus repercusiones sobre la producción, el empleo de calidad, el progreso técnico y, en definitiva, por el elevado valor social que aportan. El momento actual parece propicio para esta reforma. La avalan las promesas electorales realizadas en 2023 y la necesaria adecuación al Reglamento (UE) 2021/2282 del Parlamento Europeo y del Consejo, de 15 de diciembre de 2021, en materia de evaluación de tecnologías sanitarias.
Gráfico 1. Propuesta de organización de la evaluación en el ámbito de la salud.
El webinar de Economía y Políticas de Salud celebrado el pasado 12 de diciembre de 2023 en el que se presentaron estas notas técnicas está disponible en el canal de Youtube de Funcas.














